Suponhamos um oscilador harmônico cuja massa possui também uma carga. Seja ![]() a freqúência natural do oscilador. Posto numa região onde existe radiação em equilíbrio térmico, o oscilador executará oscilações forçadas, sendo a ``driving force'' a força elétrica que atua sobre a carga. Planck mostrou que, no equilíbrio (a dissipação considerada é a reação da radiação) estabelece-se a seguinte relação:
a freqúência natural do oscilador. Posto numa região onde existe radiação em equilíbrio térmico, o oscilador executará oscilações forçadas, sendo a ``driving force'' a força elétrica que atua sobre a carga. Planck mostrou que, no equilíbrio (a dissipação considerada é a reação da radiação) estabelece-se a seguinte relação:
Heinrich Rubens e Ferdinand Kurlbaum realizaram, em 1900, medidas na região do infra-vermelho (
Em 7 de outubro, um domingo, Rubens e sua esposa visitaram os Plancks, e Rubens relatou que achara que ![]() devia ser proporcional a
devia ser proporcional a ![]() para
para ![]() pequeno, o que era inconsistente com a fórmula de Wien. Logo que as visitas saíram, Planck atacou o problema de achar uma nova fórmula empírica que satisfizesse a nova exigência, e obteve, já numa notação que ele introduziria dois meses depois
pequeno, o que era inconsistente com a fórmula de Wien. Logo que as visitas saíram, Planck atacou o problema de achar uma nova fórmula empírica que satisfizesse a nova exigência, e obteve, já numa notação que ele introduziria dois meses depois
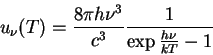
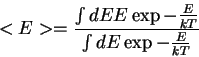 = \frac{\int dE E \exp{-\frac{E}{kT}}}{\int dE \exp{-\frac{E}{kT}}} \end{displaymath}" width="199" border="0" height="57">
= \frac{\int dE E \exp{-\frac{E}{kT}}}{\int dE \exp{-\frac{E}{kT}}} \end{displaymath}" width="199" border="0" height="57"> 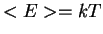 =kT$" width="103" align="middle" border="0" height="34">, e a fórmula (incorreta) de Rayleigh. De maneira inteiramente pragmática, para obter a fórmula que inventara, Planck supôs que, na interação dos osciladores com a radiação, ou seja, na interação da radiação com a matéria, no equilíbrio, as energias possíveis eram da forma
=kT$" width="103" align="middle" border="0" height="34">, e a fórmula (incorreta) de Rayleigh. De maneira inteiramente pragmática, para obter a fórmula que inventara, Planck supôs que, na interação dos osciladores com a radiação, ou seja, na interação da radiação com a matéria, no equilíbrio, as energias possíveis eram da forma 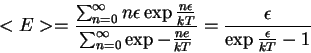 = \frac{\sum_{n=0}^{\infty}n\epsilon\exp{\-\frac{n\epsil... ...frac{ne}{kT}}} = \frac{\epsilon}{ \exp{\frac{\epsilon}{kT}}-1} \end{displaymath}" width="311" border="0" height="53">
= \frac{\sum_{n=0}^{\infty}n\epsilon\exp{\-\frac{n\epsil... ...frac{ne}{kT}}} = \frac{\epsilon}{ \exp{\frac{\epsilon}{kT}}-1} \end{displaymath}" width="311" border="0" height="53"> 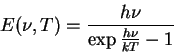
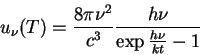
O segundo princípio da teoria mecânica do calor, levado às últimas conseqüências, é incompatível com a suposição de que existem átomos finitos. É de se pressupor, por este motivo, que no desenvolvimento da teoria venha a se travar uma guerra entre essas duas hipóteses, que custe a vida a uma delas. Se o resultado dessa luta ainda não pode ser predito com segurança, diversos indícios parecem sugerir que, apesar dos sucessos da teoria atomística até o presente, teremos que optar pela hipótese de uma matéria contínua.''
Em 14 de dezembro de 1900, o segundo capítulo da palestra de Planck na Sociedade Alemã de Física, começa com o título:Entropia requer desordem. Diz Jost, ``Planck havia capitulado a Boltzmann''.
A solução completa e rigorosa (do ponto de vista físico) do problema do equilíbrio da radiação com a matéria foi dado por Einstein em 1916. Neste extraordinário artigo Einstein estuda o equilíbrio da radiação com um átomo "genérico'', isto é, caracterizado apenas por ter níveis de energia. Livra-se assim de todas as complicações do teorema de Kirchhoff.
O quantum de energia é reconhecido como a energia de um fóton, e o equilíbrio só se dá se se admitir a existência do fenômeno da emissão espontânea. Vinte anos depois Dirac mostraria que este fenômeno aparece naturalmente ao se tratar o próprio campo eletromagnético como um sistema quântico. Assim, da concepção de Planck de uma natureza contínua, não sobrou pedra sobre pedra.
PARTE I PARTE IIPARTE III
Nenhum comentário:
Postar um comentário